<材料と方法>
材料と方法
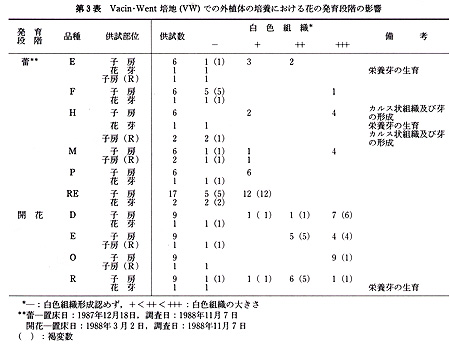
本実験に供した15品種は,いずれも京都大学農学部附属農場,古曽部温室で栽培,保存しているもので,普通に栽培したものである(第1表).
これらの品種から,蕾あるいは開花時の花を採取し,各実験に供した.前者では花茎を数cmつけた状態で,後者では数cmの花茎をつけ,花弁を切除した状態で,以下の滅菌処理を行った.まず,70%エチルアルコールに数秒間浸漬したのち,5%(Ś/v)アンチホルミン液に15分間浸漬した.ついで,滅菌水で洗ったのち,各外植体を切り取り置床した.
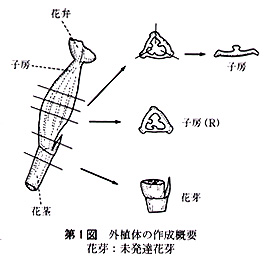
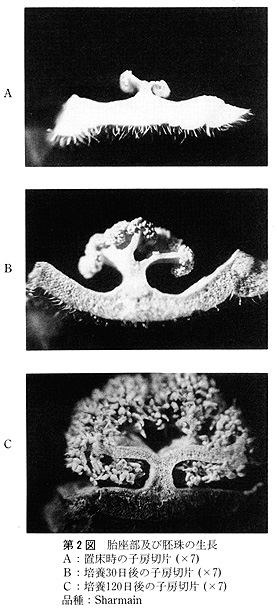
供試した外植体は,次のように作成した.花茎切片は子房の直下から長さ3〜5mmの円筒形に切ったもので,1本の花茎から2〜3切片を切り取った.子房は蕾のばあい,子房の長さが非常に短いので,上端及び下端を各1mm程度切除した残りの部分を,長さ紛5mmに切り,さらに縦に3分割したものである.開花した花では子房は長さ3〜5cmと長いので,子房の中央部分を長さ約5mmに切り,縦に3分割したものである.なお,子房(R)は3分割しなかった輪状の切片である.
未発達花牙(‘花芽’とする)は,第1花の横に位置している芽で,長さ1〜3mmの子房組織及び長さ約3mmの花茎組織をつけたものである(第1図).
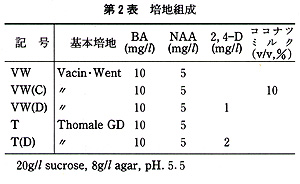
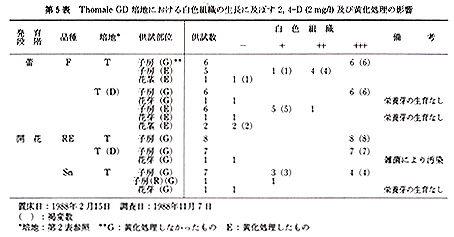
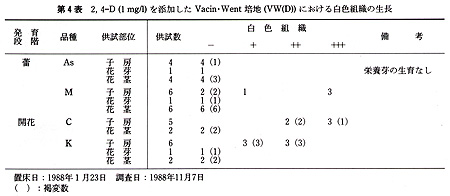
花の黄化処理は黒ビニル袋をかけて行った.培地の主要塩類組成は,Vacin・Went及びThomale GDの処方で,添加した植物生長調節物質は,5mg/L
1−naphthaleneacetic acid(NAA),10mg/L 6−benzyladenine(BA)及び1,2mg/L
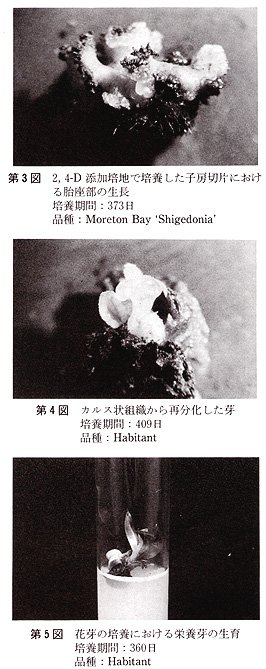
2,4−dichlorophenoxyacetic
acid(2,4−D)である.また,有機物としてココナツミルク(10%,v/v)を使用し,Sucroseは20g/L,agarは8g/Lとした(第2表).
継代は30〜40日間隔で行い,培養条件は25℃,3,000 luxで,10.5mm x 100 mmの試験管に1切片ずつ置床した.
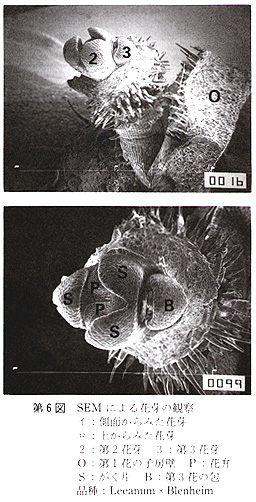
光学顕微鏡(Ž−Tr,オリンパス)及び走査形電子顕微鏡(SEM,JSM−T100,日本電子)による花芽,及び白色組織の観察は,各々の組織をアセトンにより脱水処理し,臨界点乾操装置(JCPD−5,日本電子)で乾燥後に行った.なお、SEMによる観察には金コーティング処理を施した.