|
山形県立村山農業高等学校 斎藤信俊(教諭)、三沢正美(実習教諭) |
 |
|
| 2002年12月、新企画出版局(03-3541-1141)が出版した自然と野生蘭に、ここで紹介するすばらしい記事がありました。このタイトルは「難発芽性カキランのPLB形成に成功!」だったのすが、熟読した結果、これを発芽にラン菌が利用できるというだけのただの読み物とし終わらせるのはあまりにも残念に思い、読まれた方々がそれぞれ何らかの形で利用できるかも知れないという建設的な立場で理解・利用して頂きたいと願い、タイトルを含めて全体の構成を実験レポートの体裁に変更して紹介することにしました。内容が変更されているわけではありませんので、オリジナリティーが失われたわけではありませんが、編集者や著者へ心からお詫びを申し上げます。尚、この原稿の掲載に当たり新企画出版局の許可を得てますが、承諾無しの転載はお断りいたします。 |
| ラン菌共生による難発芽性カキランの発芽 |
|
山形県立村山農業高等学校 斎藤信俊(教諭)、三沢正美(実習教諭) |
 |
|
<要約> 実生による発芽が困難とされているカキランの種子が、無菌培養ではなく、ラン菌接種による共生発芽によって発芽し、さらに、生育してPLB形成が認められまでに至った。共生菌の種類については、10種のランから分離したラン菌を用いて比較検討したところ、アツモリソウ菌とミヤマウズラ菌が有効であった。現在PLB形成の段階ではあるが、PLBの育成培地にはベノミル剤などの殺菌剤を加えたものが有効であることが解った。今後、順調に育っていくことが確認できれば、カキランの育種ばかりではなく、難発芽性のランの育成に大きく貢献する技術開発であるといえよう。 |
|
<目的> 難発芽性地生ランには、アツモリソウ、カキラン、クマガイソウなどがあり、なかでもカキランは、特に培養が困難なものとして知られている。ナドソンによる無菌播種説とバージェフによる共生播種説の対決(1922年)で、ナドソンの無菌播種が支持を受けて以来、共生菌による共生発芽を試み人は少なくなった。この実験で、カキランの種子がラン菌との共生で発芽したので、その実験経過を報告する。また、共生ラン菌には10種類のランから分離したラン菌を用い、カキランの発芽と相性がよい菌を検討した。 |
|
<材料> カキランの種子:鉢植えのカキランをよく肥培管理して開花した花に交配、その後40〜50日のさや(果実)を採取した。実験に使用したのは、さやの中からかきだした未熟種子。通常カキランの種子が完熟するのは、60〜70日程を要する。地域差にもよるが、60〜70日でさやが割れはじめるので、割れたさやの種子を播種するときには可能な限り無菌的に滅菌試験管に採取した。 |
 未熟種子(交配後40〜50日) |
 |
 |
|
|
|
|
ラン菌分離用培地:pH4〜5 ( C1ementsら1979 ) 播種用培地:エンバク寒天培地、pH5.2〜5.5 プロトコーム様体(PLB)の育成培地:MS培地(無糖、pH5.8)、ベノミル剤40mg/L ラン菌の分離に用いたランの種類(10種):ウチョウラン、シュンラン、コクラン、カキラン、パフィオペディルム、シンビジュウム、アツモリソウ、シラン、ミヤマウズラ、ネジバナ。菌種名は未同定。 ラン菌生育抑制剤としての殺菌剤:テトラサイクリン塩酸塩、ストンプトマイシン硫酸塩、ベノミル剤。 |
|
<方法> 種子の殺菌:次亜塩素酸ナトリウム(NaClO)を減菌水で有効塩素濃度を1%に希釈し、種子を5分問、試験管ミキサーで殺菌した。次亜塩素酸ナトリウムによる殺菌は単なる殺菌効果だけではなく、傷つけ処理(胚を無傷の状態で種皮を化学的に傷をつける効果)を行うことを目的とする。 |
 |
 |
次亜塩素酸ナトリウム溶液をピペット(減菌済み)で捨て、減菌水で3分間の洗浄を2回繰り返した。滅菌水を除き、残った種子を播種に用いた。1つのさやからフラスコ5本は播くことができた。 |
|
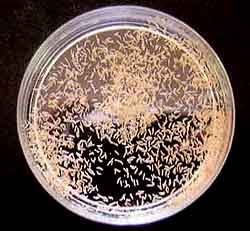
ラン菌のランの根から分離:ラン菌を採取するランの根を洗い、70%エタノール1秒、塩化水銀(昇汞、使用禁止消毒剤です:田中)1000倍液に10秒浸して減菌水で洗浄した。その後、消毒液を含んだ根の両端を切り捨て、中央部分を1mmの輸切りにして分離用培地に植えつけた。ウチョウランなどの球根の場合には、表皮をむいて同様に行うと分離しやすい。 ラン菌の純化:PDA培地。ジャガイモ200g/Lをサイの目に切り炊て柔らかくし、ショ糖、寒天を加えた。共生菌分離用培地で菌糸が発生したら、他の雑菌に汚染されないように菌糸の一部をかきとって減菌水で希釈し、PDA培地に接種した。場合に応じ、これを繰り返してラン菌を純化した。 |
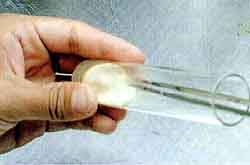
| カキラン種子の播種とラン菌の接種:洗浄を終えた種子をピンセットで播種用培地に置いた濾紙(3cm角)上に丁寧に植え付けた。分離したラン菌をそれぞれ、ピンセットでひとつまみ(耳掻き程度)を播種した濾紙の一端に接種した。その後、アルミホイルで蓋をして、20℃の暗黒で1か月培養したあと、22〜25℃の照明培養条件に移して培養した。このとき、すでに菌糸が培地表面に放射状もしくは同心円状に広がり、播種した種子に到達していた。菌糸は傷つけ処理をした種子の表面のすき間から入り込み胚に到達していると考えられる。 |
 |
 |
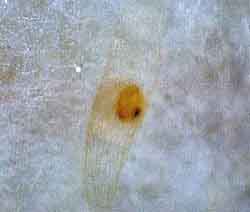 |
| アツモリソウの菌をピンセットでひとつまみとって接種する。 | 発芽(PLB形成)前の状態。周囲はアツモリソウから分離した菌。 |
|
<結果と考察> 播種後60日で、カキランの種子は発芽した。カキランの発芽に有効なラン菌は、アツモリソウから分離した菌(アツモリソウ菌)とミヤマウズラから分離した菌(ミヤマウズラ菌)であった。 カキランとアツモリソウの自生している環境を比較すると、標高差は大きく、両者の接点は認めにくく、これらの関係は不思議としかいいようがない。本校でカキランがラン菌による共生発芽に成功したのは平成13年のことで、このとき、次亜塩素酸ナトリウム溶液による傷つけ処理を行わないで播種していた。また、カキランが培地上で発芽するための熟度はたいへん微妙であることは解っていた。しかし、傷つけ処理を伴う発芽は偶然に見いだされた。学生の一人が交配後40日未満のカキランのさやをとろうとしたとき、さやを落として足で踏んでしまった。そこで、この種子を次亜塩素酸ナトリウムの1%溶液で滅菌し、ラン菌を接種した濾紙の片隅に播種して発芽という結果を得ることになった。 |
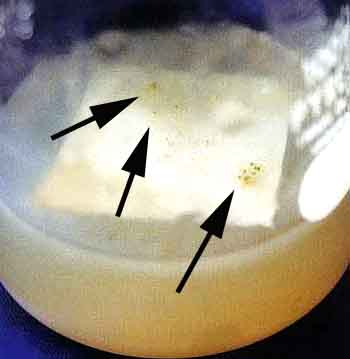 |
|
PLB確認:2002年10月9日 |
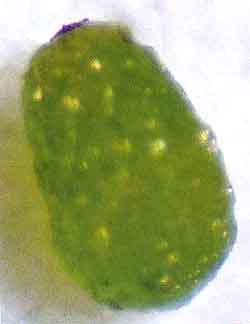 |
|
|
この研究を本校で始めてから5〜6年になる。事前研究は比較的発芽が容易なウチョウランを用いて共生発芽を試みた。ウチョウランの発芽に有効だったラン菌は、シュンラン菌とコクラン菌であった。これらのウチョウランはその後も培地培養され鉢上げを行い、今年(2002年)開花した。播種に用いた種子は完熟に近い90日程度の種子で、傷つけ処理も春化処理もせずに最短30日でプロトコーム様体(PLB)を形成した。鉢上げまでの過程で最も困難なのは、PLBを培養し続ける培地の組成である。培地にショ糖を加えるとラン菌が繁茂しすぎてウチョウランを堤没させてしまった。ウチョウランとラン菌の共生バランスを成立させるという問題を解決するために数年を要した。その培地の最大の課題はラン菌をいかにコントロールするかであった。ラン菌の抑制試験をはじめ、ラン菌の繁殖を抑制することに重点を置いた。抑制は第一に無糖、第二に殺菌剤を加えることで効果が上がった。除菌培地としても使用されているテトラサイクリン塩酸塩、ストンプトマイシン硫酸塩、ベノミル剤などを検討したところし、ベノミル剤が最も効果的であった。ラン菌を生かさず殺さずの濃度を検討し、40mg/リットルで培地に添加することが決定した。糖がないフラスコの中でランの胚を培養しながらラン菌と共生させることが重要な課題である。基本培地はハイポネックスやLS,MSなどについて検討したところ、比較的安定にラン菌をコントロールできたのは、MS培地であった。このようにしてPLB育成培地が完成した(材料参照)。その後、鉢上げしたウチョウランは、ラン菌による順化をすでに終えていることもあって、とても丈夫で強健に育った。 上述したウチョウランの基礎研究がそのままカキランに応用するとは思えないが、ひとつのラン菌を利用した培養の指針になるものとしてとらえている。今後、カキランをどのように継体培養していくかが課題である。 |
|