|
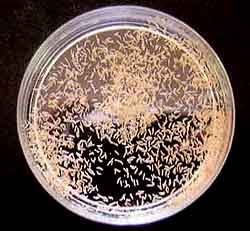
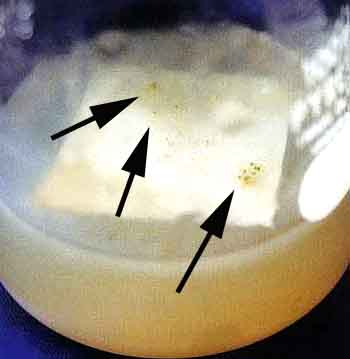
Aynbiotic bacteria isolation medium:pH4〜5 ( C1ementsら1979 )
NaN03 300mg、KH2P04 200mg、MgS04・7H20 100mg。
KC1 100mg、Yeast extract 100mg、Streptomycin sulfate 50mg
sugar 5g、agar 12g、DDW 1000m1
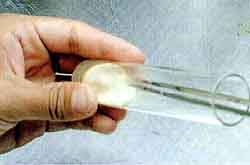
Seedling medium:Oats agar medium (pH5.2〜5.5)
25g of Oats was boiled in 1000 ml of DDW, lye was taken off, added DDW to be 1000 ml and added 10 g of agar.
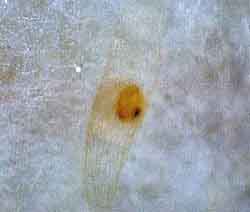
PLB growing medium :MS Medium (Withought sugar、pH5.8)、Benomyl 40mg/L
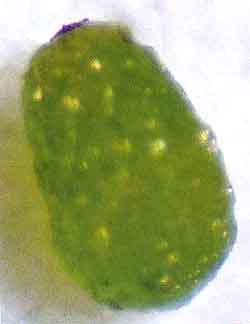
10 kinds of Japanese orchid for isolation of symbitic bacteria :Uchouran, Shunran, Kokuran, Kakiran, Paphiopedilum , Cymbidium, Atsumorisou, Shiran, Miyamauzura and Nejibana. The scientific name of bacteria was not identified.。
ラン菌生育抑制剤としての殺菌剤:テトラサイクリン塩酸塩、ストンプトマイシン硫酸塩、ベノミル剤。
|